Lexikon
Schwefel
Schwefel
Schwefel
Gewinnung
© wissenmedia
Schwefel: Kristallformen
Schwefel: Kristallformen
Schwefel tritt in zwei verschiedenen Kristallformen auf: als rhombischer Schwefel (Sα) bei Temperaturen unter 95,6 °C und als nadelförmiger, monokliner Schwefel (Sβ) bei Temperaturen zwischen 96 °C und dem Schmelzpunkt von 119 °C. In beiden Fällen liegen gewellte Molekülringe vor. Plastischer Schwefel besteht dagegen aus langen, zickzackförmig verlaufenden Ketten.
© wissenmedia
Verbindungen
Schwefelwasserstoff (H2S), kommt in manchen Heilwässern natürlich vor, Geruch nach faulen Eiern, giftig, Verwendung u. a. in der analytischen Chemie, da er mit Schwermetallen schwer lösliche Salze, die Sulfide, bildet. Schwefeldioxid (SO2) in wässriger Lösung ergibt die schweflige Säure (H2SO3), deren Salze Sulfite heißen. Schwefeltrioxid (SO3) entsteht aus dem Dioxid durch Oxidation und hat als Anhydrid der Schwefelsäure große Bedeutung für deren Herstellung; Schwefelkohlenstoff (CS2) ist eine leicht entzündliche Flüssigkeit, wird als Lösungsmittel für Fette und Harze verwendet, ferner bei der Herstellung von Viskoseseide.
Wissenschaft
Portrait eines Außenseiters
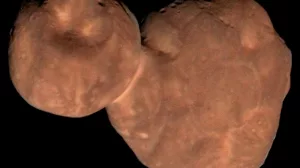
Jenseits von Pluto gibt es urtümliche Fels- und Eisbrocken wie sonst nirgendwo im Sonnensystem. Die Raumsonde New Horizons hat erstmals einen davon aus der Nähe inspiziert. von THORSTEN DAMBECK Am Neujahrstag 2019 passierte die Raumsonde New Horizons in 3538 Kilometer Minimalabstand ein seltsames Objekt namens Arrokoth. In einer...

Wissenschaft
»Es herrscht Goldgräberstimmung«
Wirksame Naturstoffe stammen häufig aus dem Globalen Süden. Der Biologe Marco Thines spricht im Interview darüber, wie Mensch und Natur vor Biopiraterie geschützt werden sollen – und was das für die Forschung bedeutet. Das Gespräch führte SALOME BERBLINGER Herr Prof. Thines, was ist Biopiraterie? Biopiraterie ist die Nutzung von...
Mehr Artikel zu diesem Thema
Weitere Lexikon Artikel
Weitere Artikel aus der Wissensbibliothek
Weitere Artikel aus dem Wahrig Fremdwörterlexikon
Weitere Artikel aus dem Wahrig Herkunftswörterbuch
Weitere Artikel auf wissenschaft.de
Der Wetterfrosch in uns
Sternwarte der Superlative
Ein Viererpack aus Neutronen
Zweierlei Maß
Hölzerne Riesen
Die grüne Revolution
