Lexikon
Bindung
Chemie
die Kraft, die den Zusammenhalt zweier oder mehrerer Atome bewirkt. Chemische Elemente haben das Bestreben, je nach ihrer Stellung im Periodensystem durch Abgabe, Aufnahme oder Paarbildung von Valenzelektronen eine Edelgaskonfiguration zu erreichen, und verbinden sich daher mehr oder weniger heftig mit anderen Elementen oder miteinander (Elektronentheorie der chemischen Bindung). Man kann folgende Hauptbindungsarten unterscheiden:
1. Ionenbindung (heteropolare Bindung, Ionenbeziehung): Die Reaktionspartner erreichen durch Abgabe beziehungsweise Aufnahme von Elektronen Edelgaskonfiguration. Dabei entstehen negativ geladene Anionen und positiv geladene Kationen, zwischen denen eine Bindung über elektrostatische Anziehungskräfte erfolgt.
2. Atombindung (homöopolare Bindung, unpolare Bindung, Elektronenpaarbindung, kovalente Bindung): Hierbei entsteht die Bindung durch ein Elektronenpaar, das zwei Atomen gleichzeitig angehört. Dadurch erreichen beide Atome die Edelgaskonfiguration. Es sind auch Elektronenmehrfachbindungen möglich, z. B. Doppel- oder Dreifachbindungen mit zwei beziehungsweise drei bindenden Elektronenpaaren. Die Elektronen werden nicht übertragen, sondern treten in Wechselwirkung miteinander, da alle beteiligten Bindungspartner dazu tendieren, Elektronen aufzunehmen.
3. Koordinationsbindung, eine Variante der Atombindung, die nur in Komplexen (Koordinationsverbindungen) vorkommt. Hierbei stammt das bindende Elektronenpaar lediglich von einem Bindungspartner, während der andere Bindungspartner über eine entsprechende Elektronenlücke verfügt, die mit dem Elektronenpaar besetzt wird.
4. Metallbindung, die durch die Bereitschaft von Metallen zustande kommt, ihre Außenelektronen abzugeben, so dass eine negativ geladene Elektronengaswolke entsteht. Zurück bleiben positiv geladene Metallionen, die ein Kristallgitter bilden, zwischen dem sich das Elektronengas frei bewegt und die Bindung herstellt. Energiebändermodell.
Diese Arten der chemischen Bindung werden auch als Hauptvalenzbindungen bezeichnet. Daneben gibt es noch die Nebenvalenzbindungen mit schwächerer Bindungsenergie:
5. Wasserstoffbrückenbindung, die zwischen einem Wasserstoffatom mit hoher positiver Partialladung und einem freien Elektronenpaar eines elektronegativen Atoms (Fluor, Sauerstoff, Stickstoff) besteht.
6. Van-der-Waals-Bindungskräfte: Wechselwirkungskräfte zwischen unpolaren Molekülen, die infolge einer kurzzeitigen Elektronenverschiebung innerhalb des Moleküls über ein Ladungsungleichgewicht (Dipol) verfügen und sich über ihre entgegengesetzten Ladungen anziehen.
Wissenschaft
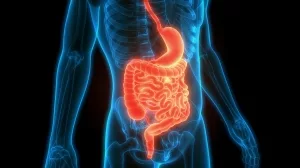
Elektrostimulation bringt den Darm in Schwung
Ist die Kommunikation zwischen Gehirn und Verdauungssystem gestört, kann es zu schwerwiegenden Magen-Darm-Problemen kommen. Dazu zählen gegensätzliche Symptombilder wie Verstopfung und Stuhlinkontinenz. In allen Fällen soll eine elektrische Stimulation der beteiligten Nerven Abhilfe schaffen. Unklar war allerdings bisher, welche...

Wissenschaft
Wie das erste Lebensjahr die sozialen Erwartungen prägt
Das elterliche Verhalten hat einen entscheidenden Einfluss auf die Entwicklung des Nachwuchses. Erfährt ein Säugling von klein auf liebvolle Zuwendung, baut er ein Urvertrauen auf und erwartet von anderen Menschen eher Gutes. Wann sich die Erwartungen der Babys allerdings formen, ließ sich bisher schwierig erforschen, da sich die...

