Lexikon
Wasserstoff
[griechisch-lateinisch Hydrogenium, „Wasserbildner“]
Wasserstoff-Isotope
Wasserstoff-Isotope
Drei Wasserstoff-Isotope: Wasserstoff, Deuterium, Tritium
© wissenmedia
Unter normalen Bedingungen kommt Wasserstoff nicht in atomarer Form vor, sondern als molekularer Wasserstoff (H2). Er ist nur mäßig reaktionsfähig. Mit Sauerstoff oder Luft bildet er ein explosives Gemisch (Knallgas). Die Knallgasprobe dient auch als Nachweis: In einem Reagenzglas befindlicher Wasserstoff verbrennt beim Anzünden mit einem Knall. Atomarer Wasserstoff entsteht durch thermische Dissoziation von molekularem Wasserstoff. Er hat, als Wasserstoff in statu nascendi, eine viel größere Reaktionsfähigkeit.
Wasserstoff findet sich in freiem Zustand kaum, dagegen ist er in zahlreichen Verbindungen vorhanden, die häufigste ist das Wasser. Wasserstoff ist aber auch in fast allen organischen Verbindungen vertreten: im Erdöl und Erdgas sowie in allen Lebewesen. Dennoch steht er hinsichtlich der Häufigkeit der chemischen Elemente auf der Erde an 9. Stelle. Aber er ist das häufigste Element im Weltall und ist z. B. der Brennstoff für die Energieerzeugung unserer Sonne.
Herstellung und Verwendung
Wasserstoff wird in großtechnischem Maßstab vor allem durch katalytische Dampfspaltung (Dampfreformierung) von Erdgas oder Leichtbenzin gewonnen oder durch partielle Oxidation von schwerem Heizöl. Bei beiden Reaktionen entsteht als unerwünschtes Nebenprodukt Kohlenmonoxid (CO). In kleinen Mengen kann man Wasserstoff durch Elektrolyse von Wasser oder durch Chloralkali-Elektrolyse gewinnen, im Labor auch durch Einwirkung von Säuren auf unedle Metalle (im Kipp’schen Apparat).
Wasserstoff kommt in roten Stahlflaschen in den Handel. Er findet umfangreiche technische Verwendung, so u. a. bei der Ammoniak-Synthese, zur Herstellung von Benzin und anderen Produkten der Petrochemie, zur Fetthärtung und anderen Hydrierreaktionen, als Reduktionsmittel zur Gewinnung von Metallen (z. B. Wolfram), ferner zum autogenen Schweißen und Schneiden, als Brenngas in Mischung mit anderen Gasen (Stadtgas, Wassergas) und verflüssigt als Raketentreibstoff, und er wird vermehrt zur Energieerzeugung in Brennstoffzellen eingesetzt. Zunehmendes Interesse findet Wasserstoff als umweltfreundliche Energiequelle der Zukunft, für deren Erzeugung Sonnenenergie unerschöpflich zur Verfügung steht. Doch ist die Gewinnung von Wasserstoff durch Solarenergie bisher noch zu teuer, um sie wirtschaftlich nutzen zu können. – H. Cavendish entdeckte das Element 1766.

Wissenschaft
Warum Kinder sich wie im Himmel fühlen sollen
Das Himmelszelt erstreckt sich über unseren Köpfen. Die scheinbar unzähligen Lichtpunkte funkeln wie präzise gestochene Löcher im samtigen Firmament. Wir suchen uns einen davon aus und zoomen an ihn heran: Das kleine Licht rast auf uns zu und wird plötzlich zu einem riesigen Feuerball, einer brodelnden Plasmakugel, die ihre...
Wissenschaft
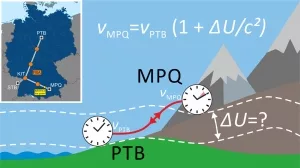
Relativistisch genau – Atomuhren messen Höhenunterschiede
Albert Einstein sagte voraus, dass die Zeit auf Bergen oder sonstigen Erhebungen schneller vergeht als im Tal – schuld sind die höhenbedingten Unterschiede in der Erdschwerkraft. Jetzt ist es Physikern gelungen, den winzigen Effekt der gravitativen Zeitdehnung für die Höhenmessung selbst weit voneinander entfernter Orte zu nutzen...
