wissen.de Artikel
Proteinfaltung: Überlebenswichtig für unsere Zellen
Faltung ist im wahrsten Sinne des Wortes der Schlüssel zum Erfolg. Denn ohne die korrekte Faltung könnte das Schlüssel-Schloss-Prinzip nicht funktionieren. Zum Beispiel zirkulieren Proteine durch unsere Blutbahn, um zu ganz bestimmten Zellen zu gelangen, in denen sie spezifische Funktionen ausüben sollen. Dafür binden sie an Rezeptoren auf der Zelloberfläche. Die Proteine haben dabei eine spezifische räumliche Struktur, die ihnen nur das Andocken an bestimmten Andockstellen erlaubt. Der Zugang zu bestimmten Zellen bliebe ihnen also ohne den „richtigen Schlüssel“ verwehrt.
Die Struktur von Proteinen ist auch wichtig, um Freund von Feind unterscheiden zu können. Antikörper, die auch zu den Proteinen gehören, erkennen schädliche Erreger beispielsweise an ihrer Oberflächenstruktur und rekrutieren daraufhin weitere Teile des Immunsystems. Die Oberflächenstruktur von körpereigenen Zellen wird von den Antikörpern hingegen als "friedlich" erkannt.
Die Faltung eines Proteins ist also essentiell, damit es seine Aufgaben in der Zelle erfüllen kann. Doch wie genau funktioniert nun diese Faltung? Und kann dabei auch etwas schief gehen?
Komplizierte Faltungen geben den Proteinen Struktur
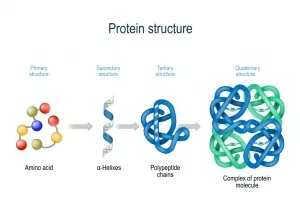
Ein normales Protein wird durch die Aneinanderreihung von etwa 100 bis 300 Aminosäuren gebildet. Dafür stehen zwanzig verschiedene Aminosäuren zur Verfügung, die jeweils anders aufgebaut sind und unterschiedliche spezifische Funktionen für das Protein erfüllen können. Zwar hat das Protein nun alle seine molekularen Komponenten erhalten, doch damit allein ist das Protein noch nicht einsatzfähig: Die Kette aus Aminosäuren muss sich zunächst so falten, dass das Protein eine bestimmte räumliche 3D-Struktur erhält. Ohne diese Struktur kann es bestimmte Funktionen nicht ausüben und es kann auch nicht von anderen Molekülen erkannt werden.
Die Aminosäurekette formt sich dafür zunächst mithilfe von bestimmten Bindungen in spiralig gewundene Helices und ziehharmonikaartig gefaltete Scheiben. Diese sogenannten Sekundärstrukturen ordnen sich dann durch weitere Bindungen in einer noch komplexeren Struktur an. Dabei muss für die Faltung ein ganz entscheidender Faktor berücksichtigt werden: Die hydrophoben – also wasserabweisenden – Teile der Aminosäurekette werden im Inneren verborgen, während die hydrophilen – also wasserliebenden – Teile auf der Oberfläche des Proteins angeordnet werden. Sie können dort mit den Wassermolekülen in der Zellumgebung interagieren.
Achtung vor Fehlfaltungen
Das mit dem Falten scheint für die Proteine ganz schön kompliziert zu sein. Aber glücklicherweise müssen sie da nicht alleine durch: Sogenannte Chaperone helfen den Proteinen in der Zelle dabei sich zu falten, indem sie die noch ungefalteten Proteine vor schädlichen Einflüssen abschirmen. Daher haben sie auch ihren Namen, denn "Chaperon" kommt aus dem Französischen und bedeutet "Anstandsdame". Während früher die Anstandsdamen noch darauf achteten, dass unverheiratete Mädchen anständig blieben, passen sie in unseren Zellen darauf auf, dass sich die Proteine vernünftig falten.
Doch manchmal kann die Faltung eines Proteins trotz der "Anstandsdamen" in der Zelle auch schief gehen. Die Folgen einer Fehlfaltung können fatal sein, vor allem, wenn die hydrophoben Aminosäuren nicht im Inneren des Proteins "versteckt" werden: Sind sie stattdessen auf der Oberfläche exponiert, interagieren sie mit anderen hydrophoben Teilen von noch ungefalteten Proteinen und können verklumpen.
Diese Verklumpung kann sich zu sogenannten Aggregaten erweitern, also einer hohen Anzahl von fehlgefalteten Proteinen, die zusammenkleben und nicht mehr funktionieren.
Wenn falsche Proteinstrukturen krank machen
Doch was genau macht die Aggregate so gefährlich für unsere Zellen? Zum einen können die aggregierten Proteine nicht mehr ihre biologische Aufgabe in der Zelle erfüllen und stören somit die Zellabläufe. Vor allem aber können sich diese Aggregate in der Zelle ablagern. Diese Ablagerungen aus verklumptem Protein werden auch Plaques genannt und sind der Hauptgrund für neurodegenerative Krankheiten, wie Alzheimer, Parkinson oder Chorea Huntington, die immer mit einem großen Verlust an Nervenzellen im Gehirn einhergehen.
Bei der Alzheimer-Demenz beispielsweise lagern sich zwischen den Gehirnzellen Plaques des Proteins Beta-Amyloid und Fibrillen des Tau-Proteins ab. Beide Aggregatablagerungen stören die Kommunikation zwischen den Nervenzellen im Gehirn und führen letztendlich zu einem Absterben der Neuronen. Diese Ursachen dieser Krankheiten zeigen also, wie immens wichtig eine korrekte Proteinfaltung in unseren Zellen ist.