wissen.de Artikel
Bohrend genial – Wie Niels Bohr das Atom verstand
Frühe Jahre und wissenschaftliche Neugier
Niels Henrik David Bohr wurde am 7. Oktober 1885 in Kopenhagen geboren. Sein Vater, Christian Bohr, war ein renommierter Physiologe, seine Mutter Ellen, geborene Adler, entstammte einer gebildeten und wohlhabenden jüdischen Familie. Bohr wuchs in einem Umfeld auf, in dem wissenschaftliche Diskussionen und intellektuelle Neugier gefördert wurden. Schon früh zeigte er ein großes Interesse an Physik, gleichzeitig war er sportlich aktiv, zusammen mit seinem Bruder Harald, der später in die dänische Fußballnationalmannschaft kam.
Nach dem Abitur an der Latein- und Oberrealschule in Gammelholm studierte Bohr ab 1903 Physik an der Universität Kopenhagen. Während seines Studiums schrieb die Königlich Dänische Akademie der Wissenschaften einen Preis aus, weshalb der junge Physiker im Labor seines Vaters Experimente zur Oberflächenspannung von Flüssigkeiten durchführte. 1907 erhielt er für seine Erkenntnisse tatsächlich die ausgeschriebene Goldmedaille. Zwei Jahre später schloss er seinen Magister ab, 1911 folgte die Promotion bei Christian Christiansen über die magnetischen Eigenschaften von Metallen.
Das Rätsel des Atomaufbaus
Im Herbst 1911 fand der frischgebackene Doktor der Physik eine Stelle am damals berühmten Cavendish-Laboratorium im britischen Cambridge, unter der Leitung von Joseph John Thomson. In einem Brief an seine Verlobte schrieb Bohr, er gehe mit „meinem albernen, wilden Übermut“ an die Arbeit. Zwar hielt er Thomson für genial, fand aber bei ihm wenig Unterstützung für seine eigenen Ideen. Im Jahr 1912 wechselte der junge Physiker deshalb auf Einladung nach Manchester zu Ernest Rutherford, der kurz zuvor das nach ihm benannte rutherfordische Atommodell entwickelt hatte.
Rutherford hatte bereits erkannt, dass der Atomkern positiv geladen sein muss und den Großteil der Masse des Atoms enthält. Die viel leichteren, negativ geladenen Elektronen müssten sich dagegen in einer Art Hülle um diesen Kern befinden. Nach den Gesetzen der klassischen Physik wäre so ein System jedoch instabil: Die um den Kern kreisenden Elektronen müssten unter dem Einfluss der Kern-Anziehungskraft elektromagnetische Strahlung aussenden, dabei Energie verlieren und dadurch immer langsamer werden – bis sie schließlich in den Kern stürzen.
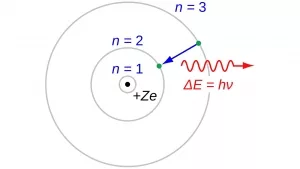
Feste Bahnen für die Elektronen
Doch ganz offensichtlich passiert dies in den Atomen nicht – Atomkern und Elektronenhülle bleiben bestehen. So begann Bohr, seine eigenen Überlegungen zum Atommodell zu entwickeln. Als Erster bezog er die experimentellen Entdeckungen Rutherfords, aber auch die von Max Planck neu formulierte Quantentheorie mit in seine Ideen ein. Die Quantentheorie postuliert, dass Strahlung wie zum Beispiel Licht nur in „Energiepaketen“, sogenannten Quanten, mit Materie interagieren kann.
Bohr übertrug diese Erkenntnis als erster auf das Atom: Er entwickelte ein Atommodell, bei dem die Elektronen den Atomkern auf bestimmten, stabilen Bahnen mit genau definierten, Energiezuständen umkreisen. Innerhalb dieser Bahnen verlieren die Elektronen keine Energie und senden auch keine Strahlung aus. Ihre Bewegung steht in einem Gleichgewicht zur Kraft, die der Kern auf sie ausübt.
Wie die Spektrallinien entstehen
Das Bohrsche Atommodell lieferte damit die Erklärung, warum die Elektronen nicht in den Atomkern stürzen. Gleichzeitig löste es aber ein weiteres Rätsel der damaligen Physik: die Spektrallinien. Bohr erkannte: Wenn man dem Atom Energie zuführt – beispielsweise in Form von Licht – nehmen die Elektronen diese Energie auf und können dadurch vorübergehend auf die nächsthöhere Bahn um den Atomkern springen. Diese Anregung hält jedoch nicht lange an und die Elektronen fallen wieder in ihre ursprüngliche Bahn zurück. Dabei geben sie die überschüssige Energie als Strahlung wieder ab. Die Wellenlänge dieser Strahlung hängt vom Element und dem Energieniveau ab – und erzeugt so eine spezifische Linie im Lichtspektrum dieses Elements. Mit seinem Modell konnte Bohr also nicht nur die Stabilität des Atoms erklären, sondern auch die bis dahin rätselhaften Linien beispielsweise im Wasserstoffspektrum. Im Jahr 1913 erschienen seine Erkenntnisse als Trilogie im „Philosophical Magazine“. Das war der entscheidende Durchbruch, für den er 1922 den Nobelpreis für Physik erhalten würde.

Karriere in Kopenhagen und internationale Anerkennung
Nach mehreren Forschungsstationen in Manchester und Kopenhagen wurde Bohr im Jahr 1916 zum Professor für Theoretische Physik an der Universität Kopenhagen berufen. Ab 1920 leitete er das für ihn gegründete Institut für Theoretische Physik und stand diesem bis zu seinem Tod im Jahr 1962 vor.
Unter seiner Leitung entwickelte sich das Institut zu einem international renommierten Zentrum für Quantenphysik, das zahlreiche berühmte Physiker anzog. Dazu zählte auch Werner Heisenberg, der später ebenfalls den Nobelpreis für Physik erhielt. Als einer der bedeutendsten Schüler Bohrs machte er entscheidende Fortschritte in der Quantenmechanik. Heisenberg verbrachte längere Zeit in Kopenhagen, lernte sogar Dänisch und pflegte eine enge kollegiale Beziehung zu Bohr. In den 1920er-Jahren prägten Bohr und Heisenberg die Kopenhagener Deutung der Quantenmechanik. Sie besagt, dass sich das Verhalten von Teilchen wie Elektronen nur in Wahrscheinlichkeiten beschreiben lässt und bereits eine Messung das System beeinflusst.
Widerstand im Krieg und Engagement für Frieden
Im zweiten Weltkrieg fanden sich Bohr und Heisenberg jedoch auf zwei Fronten wieder: Während Bohr sich im dänischen Widerstand engagierte und schließlich über Schweden nach England und in die USA floh, arbeitete Heisenberg auf deutscher Seite an der Entwicklung von Atomwaffen. Bohr selbst war in den USA unter dem Decknamen Nicholas Baker als Berater für das Manhattan-Projekt tätig, das die erste Atombombe entwickelte.
In der Zeit nach dem Krieg setzte sich Niels Bohr für die friedliche Nutzung der Atomenergie ein und warnte vor den politischen Gefahren, die mit der Entwicklung von Atomwaffen verbunden waren. Besonders engagierte er sich für mehr Offenheit und Zusammenarbeit zwischen den Nationen, beispielsweise in einem offenen Brief an die Vereinten Nationen. Für sein Engagement erhielt er 1957 den „Atoms for Peace Award“.
